Neste material você vai conhecer as características químicas, mecanismos de ação, principais ingredientes ativos, atividades nas plantas, além dos casos de resistência descritos para Phakopsora, tipos de mutação e o uso correto desses fungicidas no campo.
Os triazóis e o triazolintione são grupos químicos de fungicidas que tem como modo de ação a inibição da biossíntese de esteróis de membranas celulares do fungo (modo de ação G) (FRAC, 2017).
Dentro do grupo dos triazóis são inclusas muitas moléculas de fungicidas amplamente utilizadas na agricultura nas mais diversas culturas. Já no grupo dos triazolintione atualmente existe apenas um composto fungicida sendo utilizado no campo que é o protioconazol.
O que caracteriza um triazol?
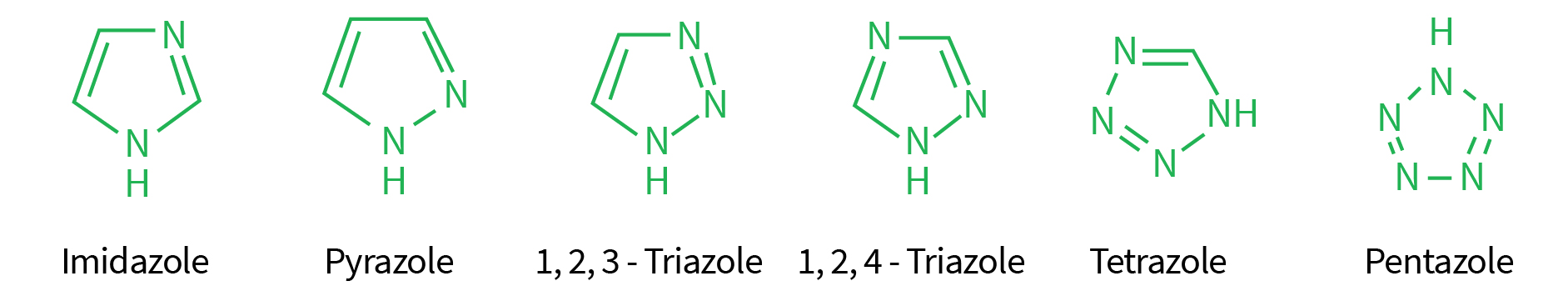
Do grego “azotikós” que quer dizer com presença de nitrogênio e assim deriva o nome de compostos azoles ou azóis.
Um azol é um composto químico contendo um anel aromático característico de cinco membros com presença de pelo menos um nitrogênio e um outro heteroátomos que pode ser outro nitrogênio, oxigênio ou enxofre como parte do anel.
Os triazóis nesse caso são aqueles compostos que possuem três nitrogênios no anel aromático característico. Estes nitrogênios podem estar nas posições 1,2,3-Triazol no anel aromático ou nas posições 1,2,4-Triazol.
A maioria dos triazóis utilizados na agricultura apresentam a estrutura na forma 1,2,4-triazol, como exemplificado no esquema abaixo (Figura 1). Já os fungicidas do grupos dos imidazóis apresentam apenas dois nitrogênios no anel aromático nas posições 1,3-imidazol.
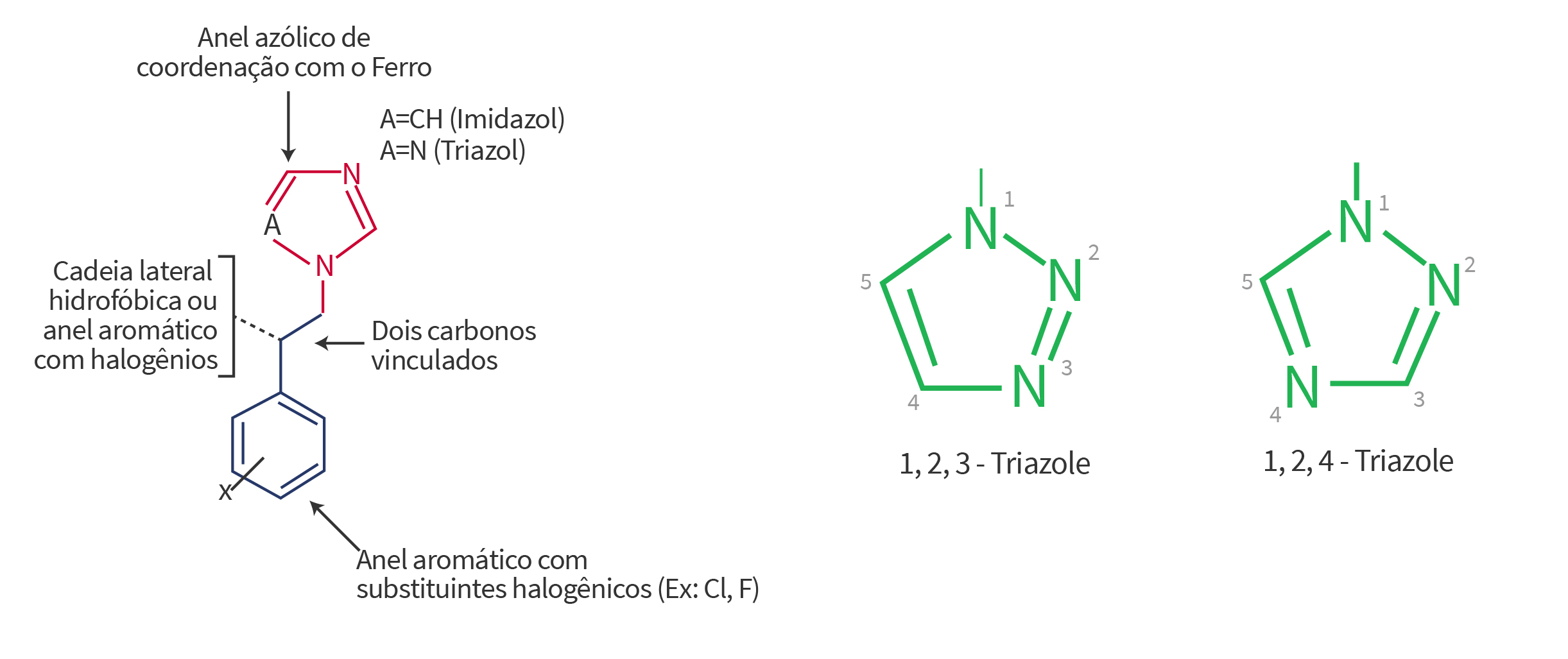
Além desse anel aromático azólico característico, a estrutura molecular geral dos triazóis envolve a presença de um anel aromático com substituintes halogênios (Ex: cloro, fluor) separados do anel azólico por dois carbonos vinculadores.
Ainda nessa estrutura geral existe a presença de uma cadeia lateral hidrofóbica que em alguns triazóis pode ser também um anel aromático com halogênios (Figura 2).
Qual a diferença do triazolintione para os triazóis?
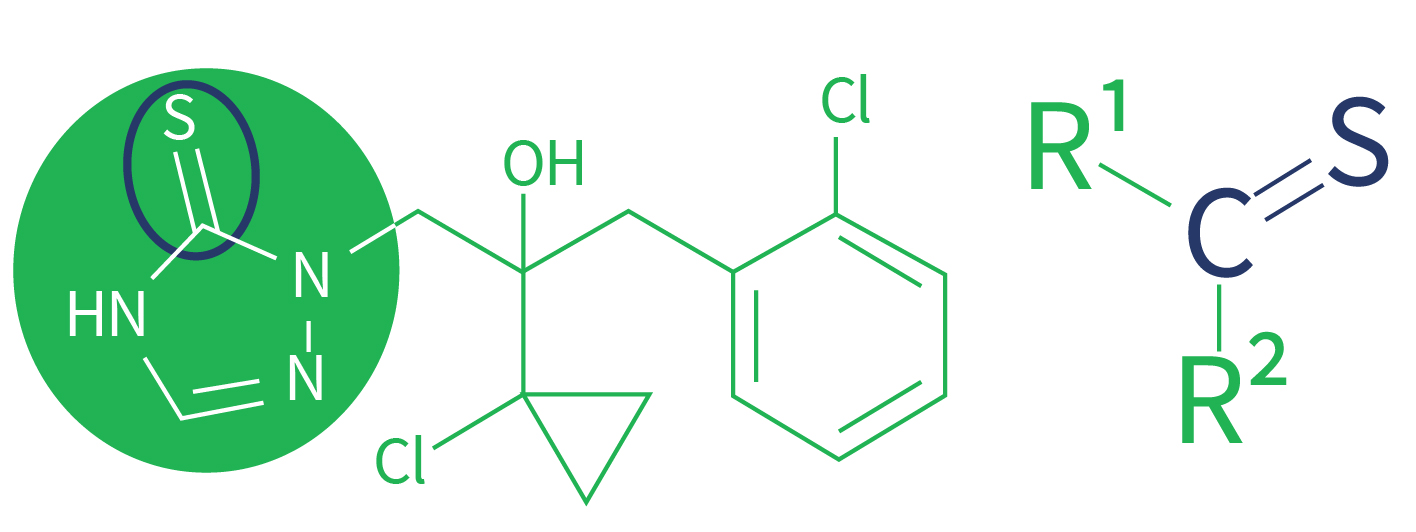
O triazolintione possui a mesma estrutura geral dos triazóis e também possui um anel aromático azólico com presença de três nitrogênios.
A diferença está na presença de uma ligação dupla de um carbono do anel aromático com um enxofre (Figura 3).
O grupamento tione tem origem de compostos organosulfuretos relacionados a cetonas convencionais (tiocetonas ou tiocarbonilos). As tiocetonas (tiones) têm a fórmula R2C = S, que é refletida pelo prefixo “thio-” em nome do grupo funcional.
Qual o mecanismo de ação dos triazóis e triazolintione?
O mecanismo de ação dos triazóis e do triazolintione é o mesmo. Ambos os compostos se ligam na enzima esterol C14-desmetilase (CYP51) a qual é necessária na rota de biossíntese de ergosterol em fungos
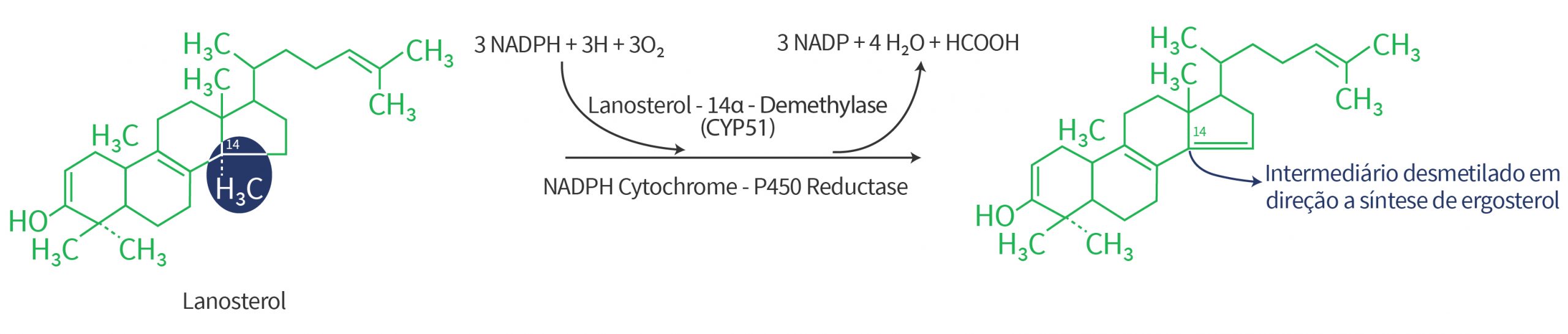
O ergosterol é um tipo de esterol que desempenha funções essenciais para a organização e estrutura da membrana celular do fungo. O ergosterol é o produto final de uma longa e complexa rota biossintética de múltiplos passos que parte da etapa inicial de conversão do composto acetil-coenzima A a esqualeno (Figura 4).
Os triazóis e o triazolintione estabelecem uma ligação direta a enzima C14?-desmetilase (CYP51) resultando assim no bloqueio da ligação do substrato dessa enzima que é o lanosterol e consequente bloqueio da rota de biossíntese em direção a ergosterol.
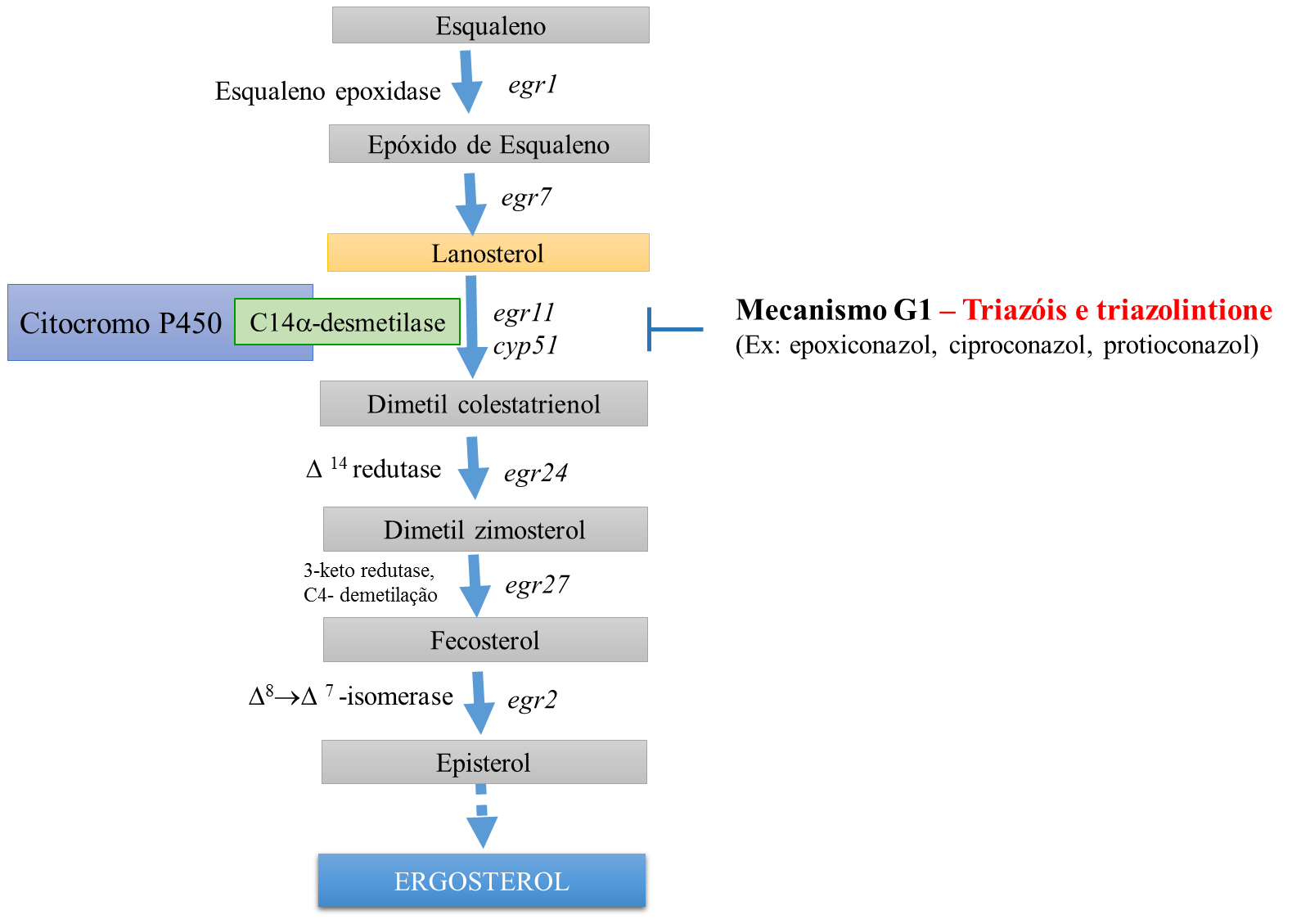
O mecanismo de ação dos triazóis e triazolintione é comumente descrito como inibidores da desmetilação (IDM).
A desmetilação do lanosterol envolve reações catalíticas de oxidação no grupo metil na posição 14 do lanosterol (Figura 5). Grupo metil (ou metila) é um radical constituído de apenas um carbono ligado diretamente a três hidrogênios devido à tetravalência do carbono (-CH3).
A inibição desse processo de desmetilação resulta no aumento concomitante de esteróis metilados, os quais não cumprem as mesmas funções na membrana e seu acúmulo acaba se tornando tóxico para a célula.
Principais ingredientes ativos e atividade na planta
Os triazóis incluem uma vasta lista de ingredientes ativos comercializados no Brasil sendo os mais utilizados em soja e outras grandes culturas o ciproconazol, difenoconazol, epoxiconazol, metconazol, propiconazol e tebuconazol. Já o triazolintione temos apenas o protioconazol como representante.
São fungicidas com ação sobre diversas classes de doenças, principalmente aquelas causadores de doenças foliares como ferrugens, manchas foliares e oídios. Também são muito utilizados no controle de antracnoses, brusones, giberelas, sigatoka na bananeira, dentre outras.
A grande maioria dos fungicidas triazóis são compostos sistêmicos na planta, os quais após serem absorvidos podem ser translocado nos tecidos no sentido acropetal. Estes fungicidas podem ter ação protetora inibindo a penetração do patógeno nos tecidos.
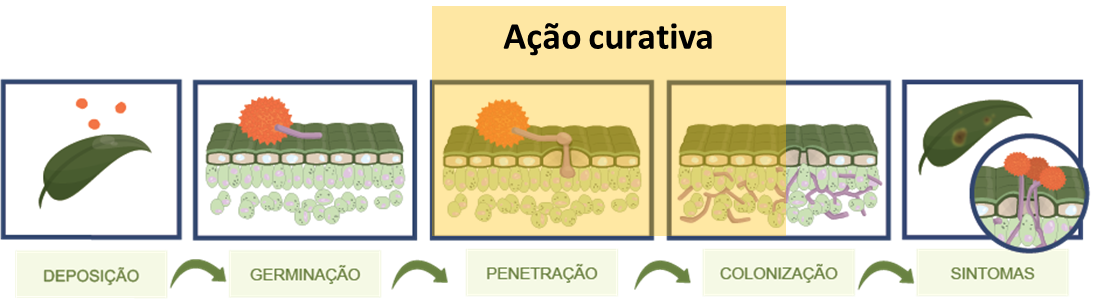
Existem estudos que demonstram que o esporo pode obter ergosterol das reservas contidas no esporo nas fases iniciais pré-infecção. Assim, atribui-se a esse fato o motivo de determinados esporos germinarem e emitirem tubo germinativo mesmo na presença do fungicida. A ação mais efetiva desses fungicidas se dá a partir da formação do apressório e emissão da hifa de infecção (Figura 6).
Quando a ação se dá nesse momento, a penetração pode ser inibida e o fungicida estaria atuando como protetor. Por outro lado, esses fungicidas podem apresentar elevada ação curativa em função da significativa penetração e translocação nos tecidos da planta.
A atividade curativa se dá pela ação desses compostos sobre o crescimento micelial após a penetração do patógeno. Assim, a infecção propriamente dita não seria inibida, mas sim o crescimento do patógeno após penetração. Na atividade curativa o desenvolvimento de haustórios e o crescimento micelial no interior dos tecidos do hospedeiro são inibidos pela presença do fungicida.
Importante!
Mesmo que apresentem ação curativa sobre o fungo (pós-penetração) estes fungicidas também são beneficiados por aplicações preventivas, assim como estrobilurinas e carboxamidas.
A aplicação desses compostos antes da chegada do fungo possibilita que sejam absorvidos, translocados e assim ficam protegendo a planta à espera do fungo.
Casos de resistência de Phakopsora pachyrhizi a triazóis
O desenvolvimento de resistência aos triazóis foi recentemente reportado em Phakopsora pachyrhizi no Brasil (Schmitz et al., 2014).
A resistência a triazóis está relacionada a mutações no gene cyp51 que condifica para a enzima de ligação com os fungicidas. As principais mutações encontradas no Brasil no gene Cyp51 foram nos códons 120, 131, 142, 145 e 475 (Figura 7).
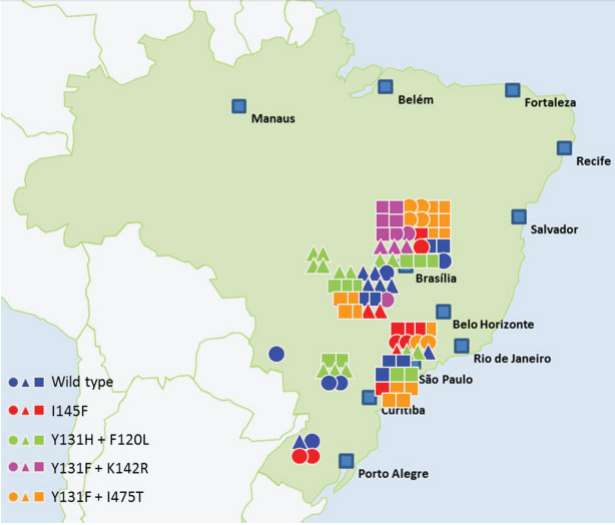
Fonte: Schmitz et al. (2014)
A maioria dos isolados apresentaram mais de uma mutação presente. Tais mutações afetam de alguma forma a eficiência de ligação dos fungicidas com o sítio alvo, o qual é alterado pela substituição de aminoácidos (Figura 8).
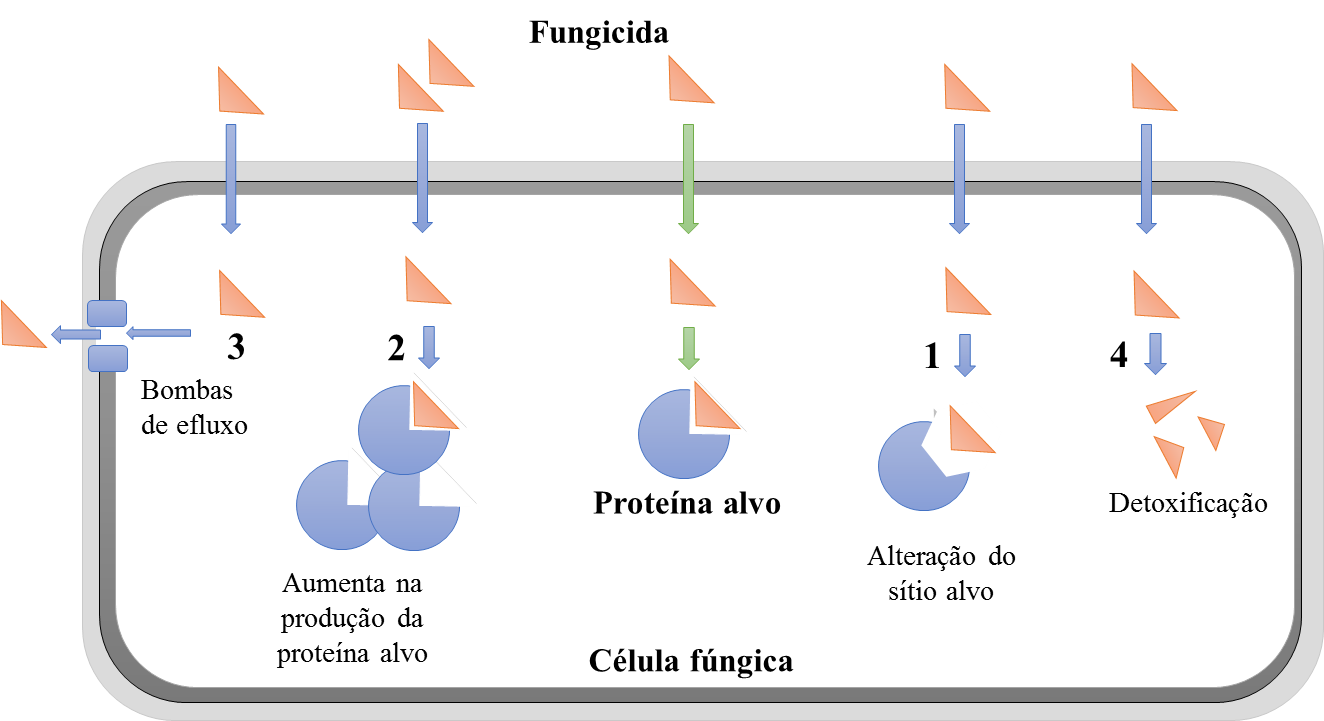
Além desse mecanismo, um outro mecanismo de resistência a triazóis foi observado em P. pachyrhizi que é a super-expressão do gene Cyp51 induzindo um aumento da produção da proteína alvo. Esta super-expressão ocorreu para todas as combinações de mutações identificadas. No entanto, se esta super-expressão está relacionada com as mutações ou se esses dois mecanismos de resistência são adquiridos de forma independente ainda não está totalmente entendido, relatam os autores.
Trabalhos revelam que isolados mutantes com resistência a triazóis podem apresentar custos adaptativos elevados o que dificulta a manutenção da sua frequência na população.
Assim, quando o uso dos fungicidas é feito de maneira errônea eleva-se a pressão de seleção e a resistência pode ocorrer. Porém, quando o fungicida é retirado ou estratégias de manejo antirresistência são adequadas, a frequência dos resistentes diminui e a eficácia dos fungicidas é retomada ou mantida.
Alerta!
O protioconazol é um fungicida que tem tido uma certa variabilidade na eficácia de controle da ferrugem da soja nas diferentes regiões do Brasil. No sul do país este fungicida ainda tem mantido uma eficácia elevada enquanto que em alguns locais do centro-oeste já se notou uma leve queda de eficácia.
O fato é que este fungicida tem sido bastante utilizado e com certeza será ainda mais nas próximas safras pelo fato da queda de eficácia das carboxamidas. Esse uso intenso submete esse fungicida a uma exposição bastante elevada no campo.
Assim, alerta-se que esse composto está em risco e que estratégias de uso adequado são necessárias para a manutenção da sua eficácia. Caso contrário, poderemos presenciar uma queda de eficácia desse composto nas próximas safras pela ocorrência de resistência.
Referências
Cools HJ, Bayon C, Atkins S, Lucas JA, Fraaije BA, Overexpression of the sterol 14?-demethylase gene (MgCYP51) in Mycosphaerella graminicola isolates confers a novel azole fungicide sensitivity phenotype. Pest Manag Sci 68:1034–1040 (2012).
Stammler G, Cordero J, Koch A, Semar M, Schlehuber S, Role of the Y134F mutation in cyp51 and overexpression of cyp51 in the sensitivity response of Puccinia triticina to epoxiconazole. Crop Prot 28:891–897 (2009).
Leroux P, Walker A, Multiple mechanisms account for resistance to sterol 14?-demethylation inhibitors in field isolates of Mycosphaerella graminicola. Pest Manag Sci 67:44–59 (2010).
Schmitz HK, Medeiros CA, Craig IR, Stammler G. Sensitivity of Phakopsora pachyrhizi towards quinone-outside-inhibitors and demethylation-inhibitors, and corresponding resistance mechanisms. Pest Manag Sci. 2014; 70(3):378-88.





6 respostas
Muito bom este material..parabéns ao autor
Que bom que gostou e muito obrigada por sua mensagem, Giovanni! Não deixe de acompanhar nossos conteúdos!
Excelente material!
Ficamos felizes que gostou, Adilson! Não perca nossos demais conteúdos e animações!
Um abraço!
Excelente Artigo!
Olá Douglas, tudo bem?
Obrigada por compartilhar seu comentário conosco!
Não perca nossos demais conteúdos e animações.
Um abraço!