- Estabelecimento da doença e órgãos afetados
- Condições e práticas que beneficiam a doença
- Evolução da doença na planta
- Descrição dos sintomas
- Inoculação e infecção da espiga
- Diferença entre diplodia e outras doenças de espiga
- Estratégias para manejo integrado da doença
Estabelecimento e desenvolvimento da doença
A cultura do milho é hospedeira de vários patógenos que parasitam seus tecidos em diversos momentos do desenvolvimento da cultura. Especificamente os patógenos do gênero Stenocarpella são praticamente os únicos que possuem a habilidade de infectar e causar danos visíveis em todas as etapas fenológicas da cultura. Germinação e emergência – Somente a S. macrospora é encontrada causando lesões sobre os tecidos foliares. Sua fonte de inóculo pode ter origem nos picnídios formados sobre a semente e/ou nos restos culturais da cultura do milho. Com o processo de embebição da semente e germinação inicia-se a fase mais vulnerável da planta à infecção pelo patógeno, causando deterioração da radícula e morte ou tombamento de pré-emergência. Outra via de infecção neste estádio é através do mesocótilo e/ou coleóptilo, obstruindo o transporte de seiva da planta e causando morte ou tombamento de pós-emergência e, consequentemente, falha de estande na lavoura. Caso o inóculo não seja suficiente para causar morte na plântula, o patógeno seguirá seu processo de multiplicação sobre os tecidos do hospedeiro desde a primeira folha emitida. Nesta situação, pode ocorrer necrose castanho claro, iniciando da ponta da folha em direção ao colar em forma de “V” (Figura 1).

Área foliar
O milho é o único hospedeiro de interesse agrícola, o que acaba por acelerar a evolução da doença em áreas de monocultura, já que o patógeno pode sobreviver no colmo infectado, em restos culturais e como micélio no endosperma e embrião das sementes. Com a hidratação dos picnídios, especialmente à noite, os cirros de conídios são expulsos e, graças às ações do vento e da chuva, atingem os órgãos vulneráveis da planta. Partindo desse inóculo inicial, os conídios de S. macrospora atingem a folha e germinam entre 12 e 15 horas após sua deposição, sob umidade relativa elevada, luz e temperatura entre 23 e 30°C (BRUNELLI et al., 2005). Geralmente o período em que a planta se torna mais suscetível estende-se da polinização completa até 20 dias após (BENSCH et al., 1992) (Figura 2). Dentre as espécies de Stenocarpella spp., a S. maydis é a mais frequente nos estados do sul do Brasil, já a S. macrospora predomina nas condições tropicais. No entanto, somente a S. macrospora é capaz de causar lesões foliares, além de possuir maior esporo e agressividade do que a S. maydis nos estágios iniciais de germinação, infecção e colonização (LATTERELL & ROSSI, 1983).
Além disso, quando a umidade relativa do ar é menor que 50%, S. macrospora produz mais micélio que S. maydis, podendo atacar a planta em qualquer estádio fenológico (DEL RIO, 1991).
Os sintomas foliares podem ser variados considerando a característica do híbrido semeado. Uma lesão foliar com ponto central de infecção é o sintoma mais comum, com halo amarelado e progressão pelas nervuras da planta (Figura 3A). No entanto, algumas derivações desta podem ser encontradas em outros híbridos, como uma lesão parda de aspecto ovalado (semelhante a E. turcicum), muitas vezes sem a identificação do ponto central da infecção e a presença ou não de halo amarelado (Figura 3B).
O ponto chave para identificação dos dois tipos de sintomas de S. macrospora é a presença de estruturas negras do patógeno sobre a lesão – picnídios. Esta estrutura do patógeno será a via de identificação da presença deste sobre todos os tecidos da planta, folha, colmo e espiga.
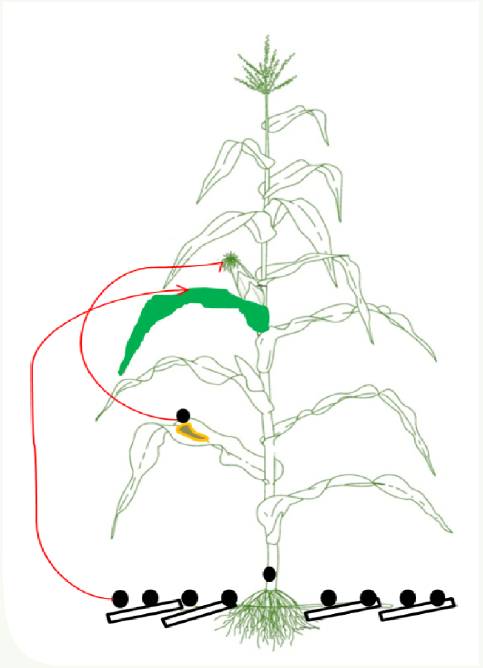
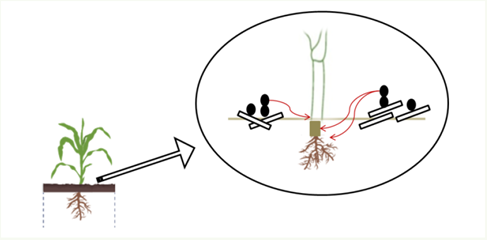
Colmo – Começam a serem visualizados no campo a partir do estádio de enchimento dos grãos, quando ocorre o maior dreno de carboidratos do colmo para os grãos. Em condições de temperatura (>25°C) e umidade altas (>80%), os picnídios são formados na resteva e irão liberar cirros de conídios, esses serão disseminados pelo vento e chuva até o milho, que é o único hospedeiro. A viabilidade do inóculo é alta e supera 90%, mesmo após 320 dias no solo (CASA et al., 2003).
O momento de infecção ideal ainda requer condições de estresse para a planta que, por conseguinte, favorece a infecção nos períodos secos seguidos de chuvosos e/ou excesso de Nitrogênio em relação ao Potássio. Assim, a infecção da Stenocarpella spp. pode ocorrer pela coroa, mesocótilo ou raízes em torno de 5 horas em temperatura de 30 C, com degeneração enzimática das ° paredes da célula do hospedeiro (BENSCH et al., 1992) (Figura 4).
Na planta, são observados no primeiro e segundo entrenós a partir do solo onde perdem a tonalidade verde precocemente, iniciando o escurecimento a partir deste nó em um gradiente escuro para pardo (Figura 5). Com a evolução da doença, a planta pode tombar exatamente neste local. Além disso, o excesso de espigas decumbentes a partir da maturação fisiológica pode ser um indicativo da presença do patógeno em híbridos que não possuem esta característica. Na parte interna ocorre a desintegração da medula, tornando-se marrom-acinzentado e os feixes vasculares permanecem visíveis e tomados por picnídios (pontos negros). Este detalhe diferencia esta doença da causada por Fusarium spp. Espiga – A chegada dos esporos à espiga através do vento e da chuva ocorre pela extrusão dos cirros de conídios dos picnídios, preferencialmente à noite, devido à hidratação destes (CASA et al., 2003). Uma característica peculiar entre as duas espécies de Stenocarpella é que apenas a S. macrospora ataca as folhas do milho (PINTO, 2006). Desta forma, passa ser outra fonte de inóculo dessa espécie para a infecção na espiga, além dos restos culturais ou do próprio colmo infectado, caso específico da S. maydis. Os conídios podem encontrar dois locais para infecção na espiga, o primeiro é o transporte destes da folha da espiga até a axila da planta pela chuva onde encontrará o pedúnculo, penetrando diretamente na palha da espiga (Figura 2) (BENSCH, 1995). O outro se dá através da deficiência de empalhamento e danos causados por insetos.

Figura 6 – Produção de micélio branco a partir da base da espiga, evoluindo para o ápice.
O período de infecção preferencial ocorre em torno de 20 dias após a polinização, com precipitação, alta umidade relativa e temperatura entre 28 a 33°C (SHURTLEFF, 1992). Além disso, é favorecida pelo excesso de Nitrogênio em relação ao Potássio, alta densidade de plantas, monocultivo e pelo dano de insetos na espiga. Com a redução na umidade do grão a 22%, a evolução da doença é interrompida, porém sem a morte do patógeno. Nas espigas atacadas, as brácteas apresentam descoloração precoce, tornando-se pardas e com baixo peso da espiga. No interior, há produção de um micélio branco que se inicia na base da espiga e progride até o ápice, entre as fileiras de grãos, através dos tecidos do esclerênquima e da placenta (BENSCH, 1995) (Figura 6), apresentando picnídios sobre eles (Figura 7). O sabugo torna-se farináceo e de baixa resistência ao manuseio (Figura 8). Híbridos com problemas de empalhamento das espigas, danos de insetos e/ou que não declinam após a maturidade fisiológica são mais suscetíveis, pois facilitam a chegada do inóculo.

Figura 8 – Aspecto visual dos grãos e sabugos da espiga sadia (A) e da espiga contaminada com o patógeno (B).
Estratégias de manejo
O foco principal é a redução do inóculo inicial da doença que dará início ao processo de epidemia, visto que o milho é o único hospedeiro de interesse agrícola e há manutenção dos restos culturais na área. Desta forma, o manejo passa pela utilização de cultivares resistentes e rotação de culturas. Além disso, evitar altas densidades de semeadura, realizar adubações de acordo com as recomendações técnicas para evitar desequilíbrios nutricionais nas plantas de milho, principalmente N-K. Quando possível evitar o dano por insetos na espiga e irrigação no florescimento. As práticas da aração e gradagem quando associadas à rotação de culturas reduzem significativamente a quantidade de inóculo no solo e, consequentemente, a intensidade da doença nas semeaduras subsequentes. A associação destas técnicas com fungicidas é fundamental, especialmente com aumento na concentração de triazois para necrotróficos e/ou multi-sítios na mistura com estrubilurina.
REFERÊNCIAS BIBLIOGRÁFICAS
BRUNELLI, K.R. et al. Germinação e penetração de Stenocarpella macrospora em folhas de milho. Fitopatologia Brasileira, Viçosa, v.30, n.2, p.187-190, 2005.
BENSCH, M.J., VAN STADEN, J. & RIJKENBERG, F.H.J. Time and site inoculation of maize for optimum infection of ears by Stenocarpella maydis. Journal of Phytopathology 136:265-269. 1992.
CASA, R.T., REIS, E.M. & ZAMBOLIM, L. Decomposição dos restos culturais do milho e sobrevivência saprofítica de Stenocarpella macrospora e Stenocarpella maydis. Fitopatologia Brasileira 28:355-361. 2003.
DEL RÍO, L. & MELARA, W. Dispersion de Stenocarpella maydis (Berk.) Sutton en un cultivo de maíz. Ceiba 32:133-140. 1991. LATTERELL, F.M. & ROSSI, A.E. Stenocarphella macrospora (=Diplodia macrospora) and S. maydis (=D. maydis) compared as pathogens of corn. Plant Disease 67:725-729. 1983.
PINTO, N. F. J. A. Inóculo multiplicado. In: Caderno Técnico Cultivar – Milho. Encarte da edição de fevereiro 2006, n.82, Revista Cultivar, 8p., 2006.
SHURTLEFF, M.C. Compendium of corn diseases. American Phytopathological Society. APS Press. Minnesota, USA. 1992.






