Neste material, você vai conhecer um pouco mais sobre:
- Os principais problemas da amostragem incorreta de fitonematoides;
- A importância da amostragem;
- Como deve ser o procedimento correto de amostragem em culturas anuais.
Existem muitos problemas relacionados à amostragem de fitonematoides em culturas anuais, muitos deles relacionados à amostragem de uma única planta, outros deles são relacionados à amostragem realizando o arranquio das mesmas.
Os nematoides parasitas de plantas, ou também chamados de fitonematoides, são organismos de corpo tubular alongado (vermiforme), microscópicos e translúcidos. Os nematoides somente ficam atrás dos insetos em relação ao número de espécies no reino animal (DECRAEMER; HUNT, 2006) e praticamente todas as plantas cultivadas sofrem danos causados por, pelo menos, uma espécie de nematoide. Sendo algumas culturas hospedeiras de várias espécies.
Nos últimos anos, os nematoides têm sido um dos principais problemas fitossanitários das lavouras e responsáveis pela redução de produtividade de diversas culturas. Embora ainda surjam novos relatos de nematoides, já são conhecidas as principais espécies causadoras de doenças e perdas de produtividade em plantas cultivadas, no que diz respeito a sua biologia, ciclo de hospedeiras, distribuição geográfica, diversidade genética, epidemiologia, importância econômica, métodos de diagnose e medidas de controle.
A variabilidade genética entre esses organismos permite que haja uma diversidade de gêneros e espécies, resultando em diferentes hábitos de parasitismo, ciclo de hospedeiras e métodos de controle.
Diante dessa realidade, o produtor ou técnico responsável deve ficar atento a sua lavoura, fazendo o acompanhamento de todos os talhões em busca de sintomas típicos nas plantas e, consequentemente, realizando o processo de amostragem nas plantas sintomáticas. De maneira geral, os sintomas aparecem através de reboleiras ou presença de plantas desuniformes na lavoura (Figura 1). Essas plantas podem apresentar algumas características bem marcantes, como por exemplo o amarelecimento de folhas e a redução de porte, indicando um forte indício da presença de nematoides nas áreas de cultivo. O sintoma de plantas amarelecidas é recorrente de uma “fome” mineral resultante do ataque dos nematoides no sistema radicular, que por sua vez interfere no crescimento, desenvolvimento e estabelecimento uniforme da lavoura.

Como confirmar a presença de nematoide na área?
A amostragem
A amostragem é o ponto crítico, ou seja, se não realizada de maneira adequada, mesmo que a análise seja muito bem feita, não irá demonstrar o que realmente tem de nematoide na área de cultivo.
Quando amostrar?
O ideal é que esse tipo de amostragem seja realizada em fase reprodutiva ou bem próxima, que coincide em torno de 50 a 80 dias após o início do ciclo das principais culturas anuais. Em culturas como soja, feijão, milho e algodão é possível realizar a amostragem e analisar a dimensão do problema 30 dias após a emergência das plântulas. Entretanto, a amostragem em época de florescimento permite aproveitar as raízes em seu período de máximo desenvolvimento, uma vez que, na fase inicial, as plantas direcionam grande parte da energia que produzem para formar tecidos radiculares, posteriormente começam a distribuir quantidade de fotoassimilados de forma equilibrada para o desenvolvimento de raízes e parte aérea, podendo então ser observado o máximo crescimento do sistema radicular. Quando se tem a formação de grãos, sementes ou frutos, a planta começa a fazer o processo reverso, mandando maiores quantidades de fotoassimilados para a parte aérea, em função da produção de novas progêneses. A partir desse ponto, as raízes começam a entrar em processo de senescência, uma vez que focaram toda a energia na produção, e os nematoides migradores vão se movimentar e sair das raízes para o solo, em busca de uma nova hospedeira para se alimentar.
Como amostrar/coletar?
A primeira forma de amostragem é conhecida como diagnóstica, isso quando se tem a presença de reboleira na área. Nesse caso, deve-se amostrar pelo menos quatro pontos equidistantes dos bordos dessa reboleira, para formar uma amostra composta (Figura 2), sempre coletando raízes e solo a uma profundidade de cinco a 30 cm.


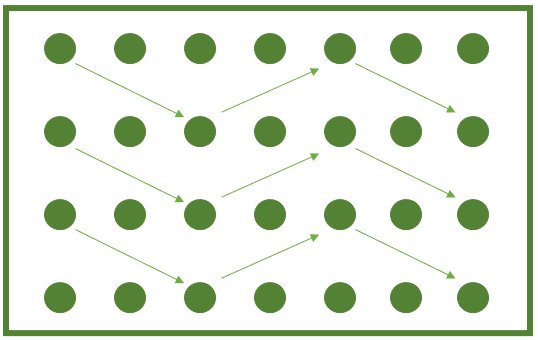
A segunda forma de amostragem é por meio do levantamento da área em zigue-zague (Figura 4), coletando de 10 a 20 subamostras de raízes e solo para compor uma amostra composta por talhão. Esse tipo de amostragem é realizada quando se quer realizar o monitoramento da área, ou mesmo quando se deseja saber se há presença de fitonematoides na gleba amostrada.
Uma das melhores ferramentas de coleta é a pá de corte, pois permite retirar de forma íntegra as raízes e o solo em seu entorno, realizando assim uma coleta de excelência (Figura 5). O arranquio manual das plantas não é um procedimento recomendado, devido a induzir a um erro de amostragem por causar ruptura do tecido radicular e perda dos indivíduos que não penetram na raiz (ectoparasitas), ou que penetram apenas metade do seu corpo no interior das raízes (semiendoparasitas).

O ideal é que, ao obter uma amostra composta de solo e de raiz, seja retirado 500 gramas de solo e pelo menos 20 gramas de raiz para ser encaminhados a um laboratório que preste serviços de diagnose de fitonematoses.
Cada amostra deverá ser embalada em sacos plásticos, fechados para evitar perda de umidade, e devidamente identificados, tais como: local, data de coleta, proprietário, nome da fazenda, cultura e outros dados que julgar necessário. Dessa forma, o laboratório responsável poderá realizar a catalogação e o arquivamento das amostras processadas.
Outro detalhe muito importante é enviar as amostras o quanto antes ao laboratório, e evitar exposição ao sol ou local onde possam aquecer. Se precisar, pode-se armazenar em caixa de isopor ou mesmo por algum tempo na parte de baixo da geladeira comum. Depois que as amostras forem processadas, os nematoides extraídos, identificados e quantificados estarão presentes em um laudo, que será remetido à pessoa interessada.
REFERÊNCIAS:
DECRAEMER, W.; HUNT, D. J. Structure and Classiäcation. In: PERRY, R. N.; MOENS, M. (eds.). Plant Nematology, Wallingford, Oxfordshire, Reino Unido: CAB International, p. 3-32, 2006.




