A fixação biológica de nitrogênio (FBN) é um importante processo biológico que viabiliza o acesso ao nitrogênio (N) do ar, na forma de N2 e a sua transformação em outros compostos disponíveis paras as plantas.
A atmosfera é farta em N2, aproximadamente 78% dos gases presente nela. A fixação por microrganismos hábeis a tal processo possibilita as plantas utilizarem o N atmosférico, sendo que ao contrário sem a ação dos microrganismos isto não seria possível pois as plantas não desenvolveram ainda tais mecanismos.
A soja e o processo simbiótico
A soja (Glycine max [L.] Merr.) é uma das principais culturas leguminosas que usufrui do processo simbiótico para obter nitrogênio para seu crescimento e produção. Os grãos de soja contêm elevada proporção de proteínas, cerca de 40% com base no peso seco, dessa forma, necessita de uma grande quantidade de N para obter um elevado rendimento.
Cerca de 8 kg de N é necessário para cada 100 kg de produção de grãos de soja. No entanto, nem todo o N demandado pela cultura é exclusivamente vindo do processo de fixação, as plantas também podem absorver nitrogênio na forma mineral disponível no solo ou oferecido em fertilizações, como o nitrato e a ureia.
A capacidade de fixar N2 atmosférico para NH3 está limitada a um pequeno subconjunto de organismos taxonomicamente diversos dentro dos procariontes. Eles podem estabelecer uma relação simbiótica, associativa ou de vida livre em relação às plantas superiores.
Simbiontes são os fixadores mais significativos de N para as plantas. Eles são representados principalmente pelos rizóbios (protobacterias), Frankia (Actinomicetos) e Nostoc/Anabaena (Cianobactéria).
Estes organismos residem em estruturas especializadas onde eles têm acesso a uma fonte abundante de energia na forma de fotossintatos e um ambiente favorável para a atividade da enzima nitrogenase através de um mecanismo de proteção do oxigênio e translocação de N fixado diretamente ao hospedeiro. Esta estrutura é chamada de nódulo. Leguminosas noduladas por rizóbios, como alfafa e soja, estão entre os mais importantes sistemas de fixação de N2 atmosférico.

Alerta-se para o caso da fertilização mineral com N, pois esta, em altas doses pode inibir o processo simbiótico. Este fato explica o porque de se utilizar pouco ou nenhum fertilizante nitrogenado na cultura da soja. Resultados de pesquisa mostram que na soja, a fixação de N pode exceder 300 kg de N ha-1, o que representa 94% do total de nitrogênio requerido pela planta (Campo et al., 2009).
Por outro lado, outros trabalhos evidenciam que plantas de soja dependentes apenas do N da FBN apresentam menor crescimento e produção de grãos, em função do declínio do processo de fixação durante a fase de enchimento de grãos.
O estabelecimento da simbiose e o início da fixação de N
Fixação de nitrogênio ocorre quando essas plantas estão em estado simbiótico com os agentes de fixação. Os principais agentes (bactérias) já identificados são dos gêneros Rhizobium, Bradyrhizobium, Sinorhizobium, Mesorhizobium, Azorhizobium e Allorhizobium (os tradicionais rizóbios a partir do alfa-proteobactéria).
Plantas hábeis a formar uma relação simbiótica com estes organismos, quando percebem uma maior necessidade de N para o crescimento liberam flavonoides no solo. Espécies de bactérias respondem à liberação deste fator, o qual é tido como uma estimulação a infecção e posterior formação de nódulos nas raízes.
A nodulação começa a se formar cerca de 10 dias após a semeadura, quando as plantas encontram estirpe compatíveis de bactérias. Nessa fase de desenvolvimento, as plantas desencadeiam a formação de pêlos radiculares, os quais apresentam deformações, que irão então permitir a entrada da bactéria na planta.
A entrada das bactérias também pode ocorrer através de fendas entre as células da rizoderme. O rizóbio em seguida, forma um canal de infecção, um tubo intercelular que penetra as células da planta hospedeira. Na sequência, após a infecção, é desencadeado rápida divisão celular nas células da raiz, formando um nódulo de tecido.
A relação entre uma leguminosa hospedeira e as bactérias fixadoras é simbiótica porque ambos se beneficiam. Uma vez a bactéria estabelecida com o nódulo formado, a planta fornece hidratos de carbono na forma de malato e succinato, e a bactéria fornece amônia que pode ser utilizado pela planta para formação de diversos compostos.
Após o nódulo estabelecido com cerca de 3 mm, ao redor de duas semanas após a emergência das plantas, a fixação de N2 é iniciada (Ito et al., 2006). O tamanho máximo dos nódulos pode atingir cerca de 6-7 mm de diâmetro, e eventualmente podem senescer e ser degradados.
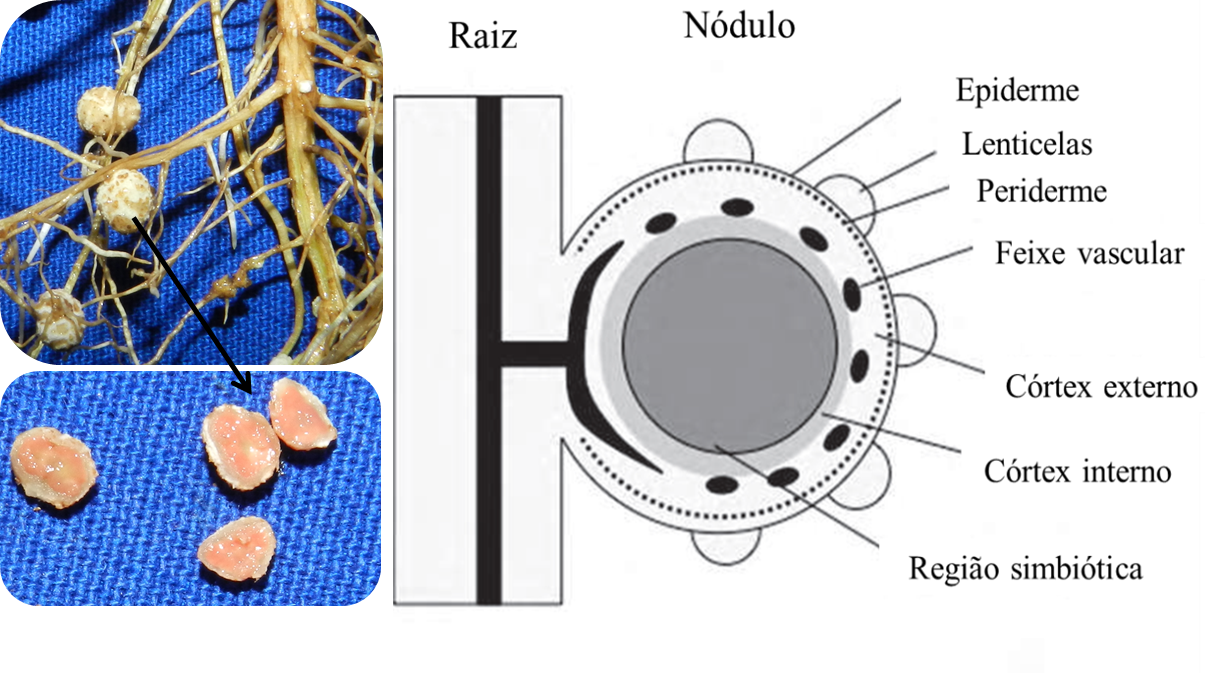
Nódulo da soja: está ativo?
O nódulo de soja é classificado como do tipo determinado, o qual tem uma forma esférica, e o crescimento se dá principalmente pela divisão das células após a infecção inicial. Este tem a região de simbiose (ou região infectada) no centro, que consiste em um mosaico de células infectadas, grandes, e células não infectadas, pequenas.
As células infectadas são preenchidas com bacteróides (formas simbióticas) e são facilmente reconhecidos pela cor vermelha, pela presença da proteína específica, leghemoglobina (Lb).
A enzima responsável pela passagem de N2 a amônia é a nitrogenase, presente nos bacteróides. A Lb em nódulos de leguminosas tem função de manter a concentração de O2 livre baixa e suficiente para a respiração bacteróide. A Lb pode ligar-se com O2 para formar LbO2 e assim reduzir a concentração de O2 nas células infectadas.
No entanto, o processo de fixação de nitrogênio e requer grande quantidade de energia e de potencial redutor, sendo assim a respiração no nódulo é muito importante. Especula-se que a respiração no nódulo é cerca de quatro vezes maior do que a de raízes e para sustentar a respiração ativa, abundante oferta de O2 é essencial.
Bioquímica da fixação de N2
Em todos microrganismos fixadores os principais passos reativos são os mesmos. A enzima chave no processo é a nitrogenase, a qual é exclusiva destes microrganismos N2-fixadores. Alguns micronutrientes como molibdênio (Mo) e ferro (Fe) são cofatores importantes associados a proteínas que componhem o complexo nitrogenase (Figura 3).

A reação catalisada pela nitrogenase requer energia (ATP) e equivalentes redutores (elétrons) advindos da ferrodoxina ou flavodoxina. O mecanismo da nitrogenase ao nível de proteína é descrito na Figura 4. Este envolve:
- formação de um complexo entre a proteína férrica reduzida com duas moléculas de ATP e com a proteína molibdênio-férrica (Mo-Fe);
- a transferência de elétrons entre as duas proteínas acopladas com a hidrólise de ATP;
- dissociação da proteína férrica acompanhada por redução e troca de ATP para ADP;
- repetição deste ciclo até que um número suficiente de elétrons e prótons se acumulam para reduzir o substrato disponível, nesse caso o N2 (Rees & Howard, 2000).
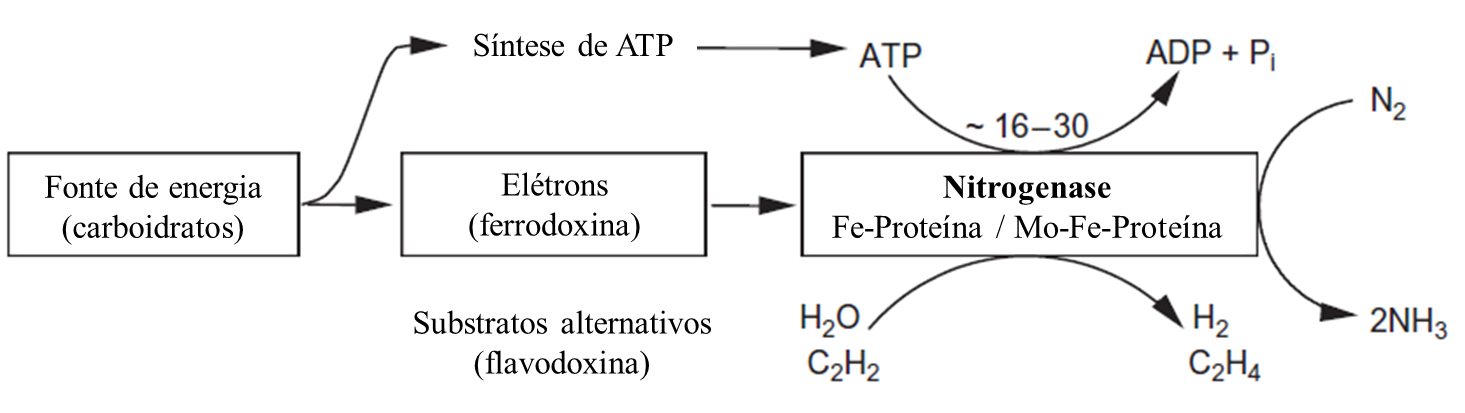
Adaptado de Evans & Barber (1977).
A grande demanda de ATP é atendida pelo catabolismo dos hidratos de carbono no processo de respiração aeróbica, acoplado com a necessidade de proteger a nitrogenase a exposição excessiva com O2. A FBN é altamente regulada em nível transcricional sob diferentes parâmetros ambientais. A reação global deste processo é apresentada a seguir:
N2 + 8e– + 8H+ 16MgATP ? 2NH3 + H2 + 16MgADP + 16Pi
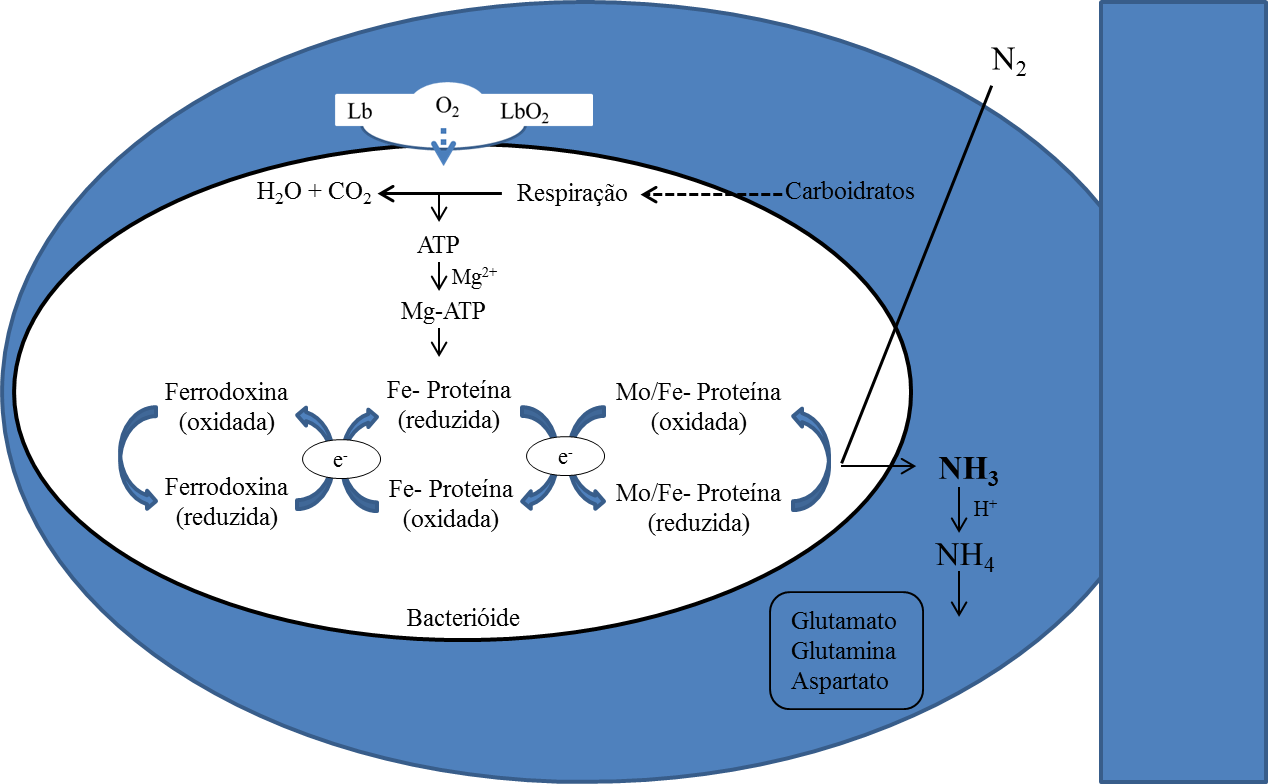
O nitrogênio fixado nos bacteróides difunde como NH3 no espaço ácido do simbiossoma (Figura 5). A partir disso, amônia é protonada a amônio, o qual é impedido de ser reciclado de volta para o bacteróide por supressão do sistema de transporte de amónio (AMT) (Tate et al., 1998).
Um canal de cátions monovalentes transporta de amônio através da membrana do biossoma para o citosol, onde é assimilado a glutamato e glutamina através da rota enzimática da glutamina sintetase (GS) e glutamato sintase (GOGAT) (Vance & Gantt, 1992).
O N fixado é entregue o xilema das plantas de leguminosas principalmente na forma de asparagina ou na forma de ureídeos.
Principais fatores que influenciam o processo de fixação simbiótica de nitrogênio
A eficiência do processo de simbiose é fortemente influenciada por condições do ambiente. Condições favoráveis ??para o crescimento da planta e do estabelecimento de populações bacterianas aumentam a taxa de infecção e desenvolvimento de nódulos nos pelos absorventes e assim influenciam no sucesso do processo de fixação.
Salinidade
A maioria das leguminosas são sensíveis a salinidade. Nesse caso, a salinidade reflete na redução do crescimento da planta afetando a simbiose. Em condições salinas, a aderência da bactéria às raízes é reduzida e os pêlos radiculares não apresentam as características que otimizam o processo de infecção que são a deformação e ondulação (El-Hamdaoui et al., 2003). O estresse salino também pode inibir invasão bacteriana e proliferação no interior das células hospedeiras (Bolanos et al., 2006).
A umidade do solo
A baixa umidade do solo pode prejudicar a nodulação e causar a morte dos rizóbios. A umidade do solo também influencia o crescimento das plantas, arquitetura de raiz e exsudação de compostos sinalizadores (Sadowsky, 2005). Uma vez que os nódulos são estabelecidos, baixa umidade reflete em redução na fixação do N2 pela redução da atividade do nódulo. Tal efeito é atribuído principalmente a um aumento da resistência à difusão de O2 no bacteróide (Durand et al., 1987).
Temperatura
Altas temperaturas prejudicam a sobrevivência e persistência de estirpes de rizóbio em solos e também em raiz após infecção (Sadowski, 2005). Mudanças na síntese de leghemoglobina e na atividade da enzima podem alterar o funcionamento do nódulo e acelerar o processo de senescência (Hungria & Vargas, 2000). Sadowski (2005) sugeriu que toda relação simbiótica (hospedeiro/rizóbio) tem uma faixa ótima de temperatura que se situa entre 25 e 40 ° C, sendo muito variável em função da espécie da cultura e da bactéria.
O pH do solo
Em solos ácidos, fatores tais como altas concentrações de H+, teor de alumínio (Alva et al., 1990) e micronutrientes (Campillo et al., 2005) que se tornam mais solúveis a pH baixo, podem contribuir para deficientes nodulação e inibição do crescimento da planta (Hungria & Vargas, 2000). Além disso, a disponibilidade de Ca e P são fortemente afetadas a baixo pH e também pode influenciar o crescimento e a sobrevivência de rizóbios (Sadowsky, 2005).
Fertilização com N mineral
Em leguminosas o N mineral pode melhorar ou reduzir a fixação de N2, dependendo de uma série de fatores e da taxa de fornecimento N mineral.
A fase de latência da bactéria, que envolve o período entre a infecção e o início da fixação, é particularmente importante, pois nesta fase há uma demanda grande de energia da parte aérea e o suprimento de N para a planta compor uma área folhar adequada torna-se essencial.
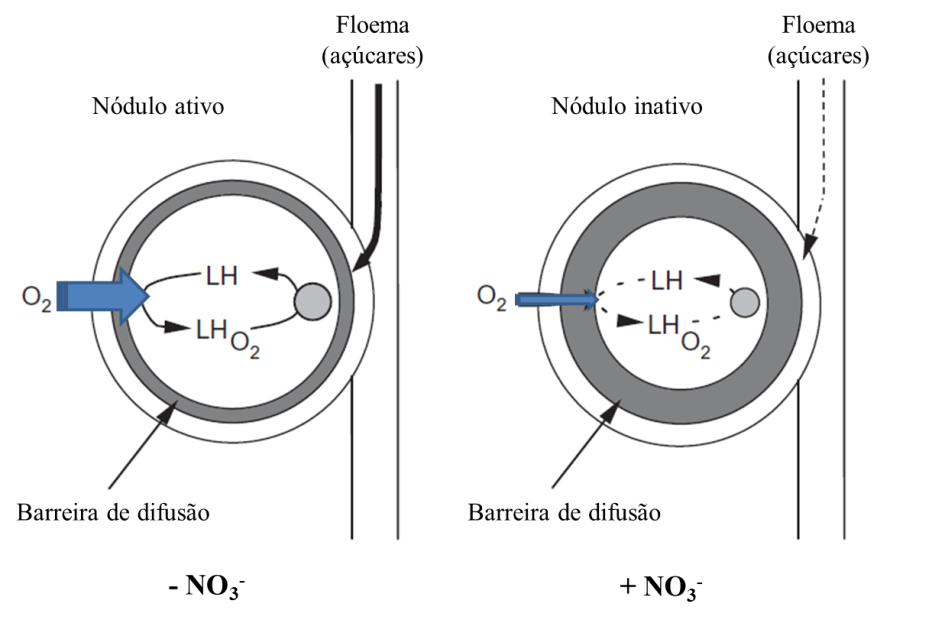
Por outro lado, a nodulação e atividade do nódulo podem ser reduzidas sob altos níveis de N mineral fornecido, o que varia em função do genótipo da planta e forma de N fornecido. A infecção e desenvolvimento de nódulos são mais sensíveis ao nitrato do que ao amônio.
O efeito inibitório do nitrato na atividade da nitrogenase em nódulos pode ser em função da toxicidade do nitrito (Becana et al., 1985) e da deficiência de O2 (Vessey et al., 1988). Nitrito no bacteróide pode inativar a leghemoglobina através da complexação com este composto (Kanayama & Yamamoto, 1991). O nitrato pode aumentar por várias vezes a resistência de nódulos a difusão de O2 (Vessey et al., 1988) (Figura 6).
Deficiências nutricionais de outros elementos
Podem afetar o processo em leguminosas em estágios bem iniciais de desenvolvimento, incluindo a multiplicação dos simbiontes na planta hospedeira e sua capacidade de detectar sinais para indução da infecção. Os nutrientes essenciais requeridos por rizóbios são aqueles com envolvimento direto na estrutura e o funcionamento metabólico da célula microbiana (O’Hara, 2001). Posteriormente, esses elementos influenciam na fixação do N2 por influenciar na infecção, formação de nódulos, atividade do nódulo e crescimento da planta hospedeira.
Aeração (O2)
O oxigênio é fator importante no processo de respiração e produção de energia na forma de ATP a qual é demanda pela rota do complexo enzimático nitrogenase. No entanto, é indispensável que se mantenha concentrações baixas de O2 no interior do nódulo porque sob altas concentrações pode haver inibição da nitrogenase.
Tipos de inoculantes
Os tipos de inoculantes comercializados atualmente no Brasil são os turfosos, líquidos e na formulação pó molhável. Os do tipo turfosos são aqueles que utilizam a turfa como veículo das bactérias.
Este tipo de inoculante oferece algumas vantagens por oferecer aos microrganismos uma maior proteção física contra adversidades do solo e por manter elevado número de bactérias viáveis.
Em contra ponto, este veículo esta cada vez mais escasso, no Brasil, por exemplo, existem poucas turfeiras, e isso acarreta na necessidade de importação desse substrato o que eleva os custos de produção.
Em comparação, inoculantes líquidos são aqueles que usam um substrato aquoso estéril como veículo das bactérias. Este tipo de formulação se destaca por ser adequada para aplicação em grande escala e por facilitar a semeadura mecanizada.
Um terceiro tipo de inoculante é na formulação pó-molhável que consiste em substrato sólido contendo bactérias liofilizadas que necessitam ser hidratadas antes da sua aplicação nas sementes.
Fixação de N e uso de fertilizantes: custos
Muitos pesquisadores têm tentado calcular os custos com carboidratos para as plantas no processo de fixação de N2 em comparação com os custos com a absorção de N mineral a partir da rizosfera.
Embora os custos de energia de fixação possam exceder os de absorção, essas comparações podem ser enganosas, porque não leva em conta o custo econômico do fertilizante nitrogenado, a baixa eficiência do uso na agricultura (aprox. 50% da quantidade aplicada é utilizada pela cultura) e os custos ambientais devido à lixiviação.
Os benefícios da simbiose para espécies leguminosas ficam evidentes a partir da oferta de N, independentemente do status de N no solo. Além disso, espécies de rizóbios podem existir e se multiplicar em vida livre no solo por décadas, mesmo na ausência do hospedeiro adequado não precisando fixar N para sobreviver.
Referências
BECANA, M.; RODRIGUEZ-BARRUECO, C. Protective mechanisms of nitrogenase against oxygen excess and partially-reduced oxygen intermediates. Physiol. Plant. v.75, p.429–438, 1989.
BOLANOS, L. et al. Nitrogenase inhibition in nodules from pea plants grown under salt stress occurs at the physiological level and can be alleviated by B and Ca. Plant Soil, v.280, p.135–142, 2006.
CAMPILLO, R. et al. Strategies to optimise biological nitrogen fixation in legume/grass pastures in the southern region of Chile. Plant Soil, v.273, p.57–67, 2005.
DURAND, J.L. et al. Nitrogenase activity, photosynthesis and nodule water potential in soya beans experiencing water deprivation. J. Exp. Bot., v.38, p.311–321, 1987.
EL-HAMDAOUI, A. et al. Effects of boron and calcium nutrition on the establishment of the Rhizobium leguminosarum-pea (Pisum sativum) symbiosis and nodule development under salt stress. Plant Cell Environ., v.26, p.1003–1011, 2003.
EVANS, H.J.; BARBER, L.E. Biological nitrogen fixation for food and fiber production. Science, v.197, p.332–339, 1977.
HUNGRIA, M.; VARGAS, M.A.T. Environmental factors affecting N2 fixation in grain legumes in the tropics, with emphasis on Brazil. Field Crops Res., v.65, 151–164, 2000.
ITO, S. et al. Allocation of photosynthetic products in soybean during the early stages of nodule formation. Soil Sci. Plant Nutr., v.41, p.438-443, 2006.
KANAYAMA, Y.; YAMAMOTO, Y. Formation of nitrosylleghemoglobin in nodules of nitrate-treated cowpea and pea plants. Plant Cell Physiol., v.32, p.19–23, 1991.
MARSCHNER, H. Mineral nutrition of higher plants. 3ed. London Academic Press, 2012. 651p.
O’HARA, G.W. Nutritional constraints on root nodule bacteria affecting symbiotic nitrogen fixation: a review. Aust. J. Exp. Agric., v.41, p.417–433, 2001.
OHYAMA, T. et al. Effect of Nitrate on Nodulation and Nitrogen Fixation of Soybean. Soyb. Phys. and Bioch., 2011. 488 p.
REES, D.C.; HOWARD, J.B. Nitrogenase: standing at the crossroads. Curr. Opin. Chem. Biol., v.4, p.559–566, 2000.
SADOWSKY, M.J. Soil stress factors influencing symbiotic nitrogen fixation. In Nitrogen Fixation in Agriculture, Forestry, Ecology, and the Environment (D. Werner and W. E. Newton, eds.), pp. 89–112. 2005. Springer, Dordrecht, The Netherlands.
TATE, R. et al. The Rhizobium gene coding for an NH41 transporter is down-regulated early during bacteroid differentiation. Mol. Plant-Microbe Interact., v.11, p.188–198, 1998.
VANCE, C.P.; GANTT, J.S. Control of nitrogen and carbon metabolism in root nodules. Physiol. Plant., v.85, p.266–274, 1992.
VESSEY, J.K. et al. Oxygen limitation of N2 fixation in stem-girdled and nitrate-treated soybean. Physiol. Plant., v.73, p.113–121, 1988




2 respostas
Boa tarde.
Trecho copiado da matéria publicada:
“Por outro lado, outros trabalhos evidenciam que plantas de soja dependentes apenas do N da FBN apresentam menor crescimento e produção de grãos, em função do declínio do processo de fixação durante a fase de enchimento de grãos.”
Quanto ao trecho que fala no retardamento do crescimento, é verificado excepcionalmente. O N existente no solo e nos cotilédones, é suficiente para nutrir as plantas até o início da fixação. Não se observa retardamento significativo, salvo em solos de péssima fertilidade.
O trecho que fala na “menor produção de grãos”, este sim, eu diria que é um erro, pois centenas de trabalhos de pesquisa e milhares de observações de lavouras, mostram que as plantas bem noduladas produzem tanto, e em certos casos até mais grãos, que as plantas adubadas com fertilizante nitrogenado. hoje, pela Embrapa, CESB, universidades diversas e milhares de agricultores, é unanimidade que uma boa nodulação leva ao máximo de produtividade da soja.
Olá, Solon. Tudo bem?
Agradeço sua contribuição e o cuidado em fundamentar o comentário com base em resultados consolidados de pesquisa e na experiência de campo.
A redução na produção de grãos refere-se a sistemas intensivos de produção, nos quais a soja é cultivada em sucessão a gramíneas como milho, sorgo ou milho consorciado com braquiária. Nesses sistemas, quando o produtor adota, ao longo dos anos, uma adubação nitrogenada restritiva para as gramíneas (utiliza menos nitrogênio que o necessário para a cultura), pode ocorrer uma redução gradual do teor de nitrogênio disponível no solo. Nesses casos, a soja de alto potencial produtivo pode não expressar toda a sua produtividade, pois depende da FBN e do nitrogênio residual do solo.
Além disso, é importante considerar que a eficiência da FBN pode ser comprometida por fatores ambientais, como deficiência hídrica, altas temperaturas e problemas de nodulação. Em cenários como esses, especialmente quando se busca produtividades na faixa de 85 a 90 sacas por hectare, a limitação no suprimento total de nitrogênio pode resultar em redução do potencial produtivo, sobretudo durante a fase de enchimento de grãos.
Não perca nossos demais conteúdos e animações.
Abraço!