A inovação tecnológica, especialmente no mercado de fungicidas, tem proposto produtos com as características a seguir:
- Seletivos;
- Efetivos em doses menores;
- Com modos e mecanismos distintos de ação;
- Mais ágeis;
- Com alto potencial protetor;
- Formulações resistentes à ação de chuvas;
- Menos tóxicos ao homem e ao meio ambiente;
- Com menor risco de selecionarem raças resistentes.
Descoberta das carboxamidas
A inovação tecnológica especialmente no mercado de fungicidas tem proposto produtos cada vez mais seletivos, efetivos em doses menores, com modos e mecanismos distintos de ação, mais ágeis, com alto potencial protetor, formulações resistentes à ação de chuvas, menos tóxicos ao homem e meio ambiente e com menor risco de selecionarem raças resistentes.
O processo de descoberta de um novo ingrediente ativo demanda tempo e investimento, uma vez que o lançamento de uma nova molécula necessita, no mínimo 10 anos entre sua síntese, desenvolvimento do processo, produção, formulação, melhoramento, testes laboratoriais, pesquisa de campo para posicionamento e registro, métodos de aplicação, análises de resíduos e toxicidade.
Para isso, o investimento é alto, sem contar que são analisadas mais de 140.000 substâncias por ano para se chegar a uma molécula comercial. Esse foi o caso do grupo químico das carboxamidas, que visava atender a todos os requisitos acima descritos. O primeiro ingrediente ativo do grupo químico das Carboxamidas foi descoberto em 1966 (carboxina).
A mais antiga das carboxamidas é a oxattin-carboxamidas. O principal ativo deste grupo é a carboxina.
No Brasil, a carboxina é amplamente utilizada em produtos para tratamento de sementes. Também tem registro para uso em diversas culturas, incluindo algodão, arroz, cevada, feijão, milho, soja e trigo.
As principais aplicações se dão para controle de fungos veiculados pela semente, causadores de podridões e tombamento, como os dos gêneros Penicilium, Aspergillus, Fusarium, Rhizoctonia; e também para controle de fungos causadores de manchas foliares, como os dos gêneros Septoria, Cercospora, Alternaria, Colletrotrichum, Pyricularia, Bipolaris, dentre outros.
A carboxina é um fungicida sistêmico que pode ser absorvido pelas raízes e dar proteção à parte aérea das plântulas em estádios iniciais de desenvolvimento.
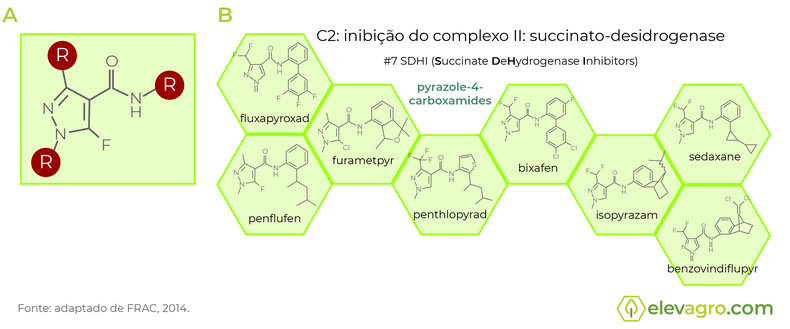
Em grandes culturas como a soja, não existia nenhum representante recomendado pelo MAPA para aplicação foliar até 2010. Deste modo, o trabalho das empresas em buscar novos ingredientes ativos chegou ao desenvolvimento dos pyrazoles-4-carboxamidas (a partir de 2010), sub-grupo das carboxamidas. Seus representantes possuem o mesmo arranjo molecular que os caracterizam, com variações nos radicais formando os ingredientes ativos diferentes (Figura 1 A e B). Assim, eles representaram um novo grupo químico a ser posicionado em aplicação foliar para cultura da soja.
Modo e Mecanismo de Ação das Carboxamidas
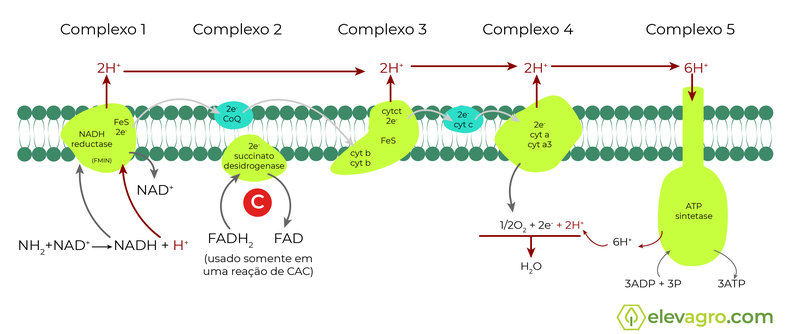
Na mitocôndria do patógeno, a respiração promove o fluxo de elétrons entre os complexos proteicos, que é fundamental para o movimento da ATP sintase, promovendo a ligação de um terceiro grupo fosfato aos dois fosfatos da adenosina. O produto desta ligação é o ATP (Adenosina TriPhosphato), encontrado universalmente nos sistemas vivos e tem como função essencial armazenar energia para as atividades vitais básicas das células. O ATP libera uma grande quantidade de energia utilizável quando é desdobrado pela adição de uma molécula de água (hidrólise).
Os ingredientes ativos do grupo das carboxamidas, assim como as estrobilurinas, atuam interrompendo este processo em complexos proteicos diferentes, privando o patógeno do principal produto, o ATP. Tecnicamente, o mecanismo de ação das carboxamidas apresenta efeito inibidor sobre a produção da enzima succinato desidrogenase (SDHI), atuante no Complexo II da cadeia de transporte de elétrons na mitocôndria do fungo, impedindo a oxidação de succinato para fumarato (Figura 2).
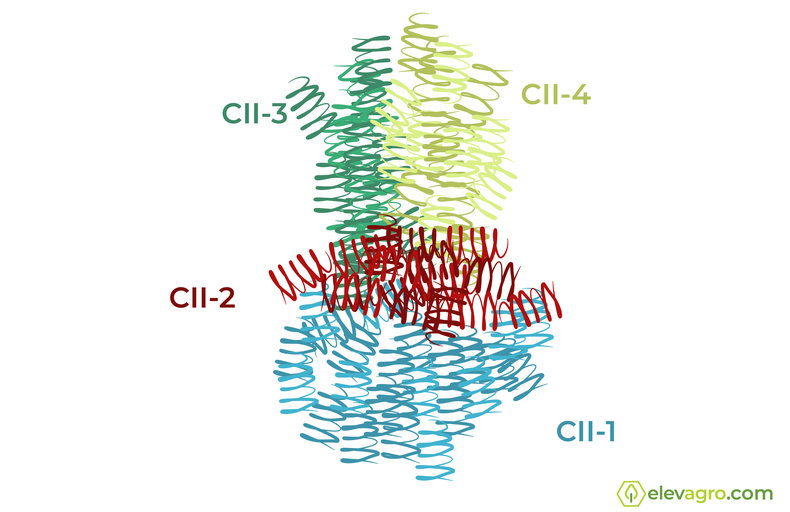
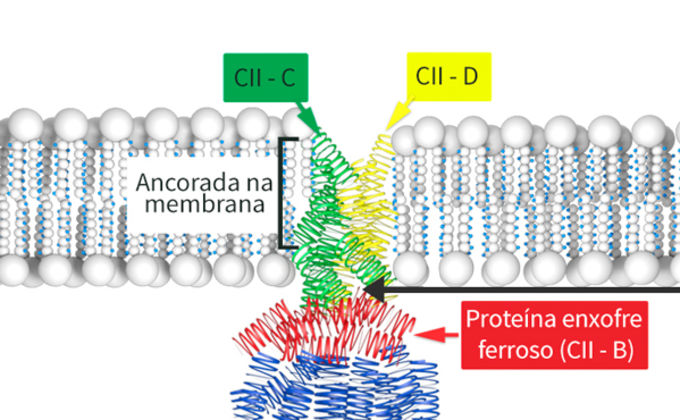
A estrutura da succinato desidrogenase (SDHI) é formada por quatro proteínas, CII-1 (flavoproteina) e CII-2 (proteína enxofre ferroso) e as proteínas CII-3 e CII-4 que são formadoras de polipeptideos ligados às membranas (Figura 3). A proteína CII-2 é responsável pelo transporte de elétrons da cadeia respiratória do complexo I para o complexo III. Já a proteína CII-3 é o principal local de ação das carboxamidas, na ubiquinona da enzima. Assim, qualquer surgimento de resistência aos SDHI depende de um novo arranjo dos aminoácidos dentro da proteína.
Em âmbito celular estudos do mecanismo de ação das carboxamidas ainda indicam seu efeito na biossíntese de proteínas, lipídeos, DNA e RNA, além de ser observado maior transformação de glicose ou acetato em succinato e uma diminuição na transformação de citrato, malato e fumarato.
Espectro de Ação
O espectro de ação sobre os patógenos é normalmente variável. Alguns fungicidas pertencentes ao subgrupo dos pyrazoles apresentam boa ação em deuteromicetos, ascomicetos e basidiomicetos (ferrugens), já outros ficam restritos a estes últimos. Além disso, podem ter sua eficácia potencializada a partir da adição de ativos dos grupos químicos estrobilurinas e triazois, conferindo maior espectro de controle, acrescentando consistência ao residual e reduzindo o risco de tolerância/resistência. Ademais, a ação dos ativos deste grupo sobre a fisiologia das plantas é notório e em maior magnitude que o apresentado pelo grupo das estrobilurinas, quando posicionados preventivamente, permitindo assim a absorção pelo tecido foliar.
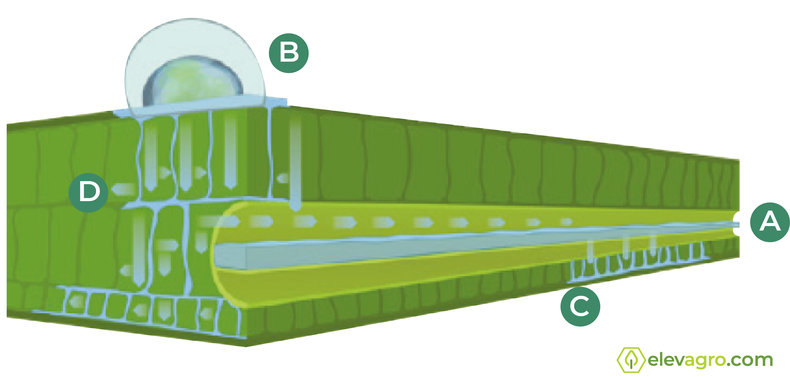
A lipofilicidade que alguns ativos deste grupo apresentam define-os como produtos de elevada mobilidade. Após a deposição dos fungicidas sobre os tecidos da planta, podem ser mobilizados através de transporte acropetal (xilema), episistêmico (adsorção na camada cerosa e redistribuição na fase vapor – grande quantidade do ativo mantem-se nestes tecidos), de forma translaminar acumulando-se na face oposta da folha e mesostêmico (episistêmico e translaminar) (Figura 4).
Existem diferenças entre ativos deste grupo químico quanto à lipofilicidade, mas alguns podem apresentar os quatro padrões de mobilidade.
Além de atuar nos esporos, micélio primário e secundário, uma redução na taxa de progresso da doença é observada de forma significativa. Dados de campo demonstram uma ação fortemente preventiva – fato suportado tecnicamente, pois a fase de maior demanda de energia (ATP) pelo patógeno está no momento pré-infecção. Em ensaios conduzidos com aplicações curativas ou ainda erradicativas ficou evidente uma perda significativa de residual (Figura 5).
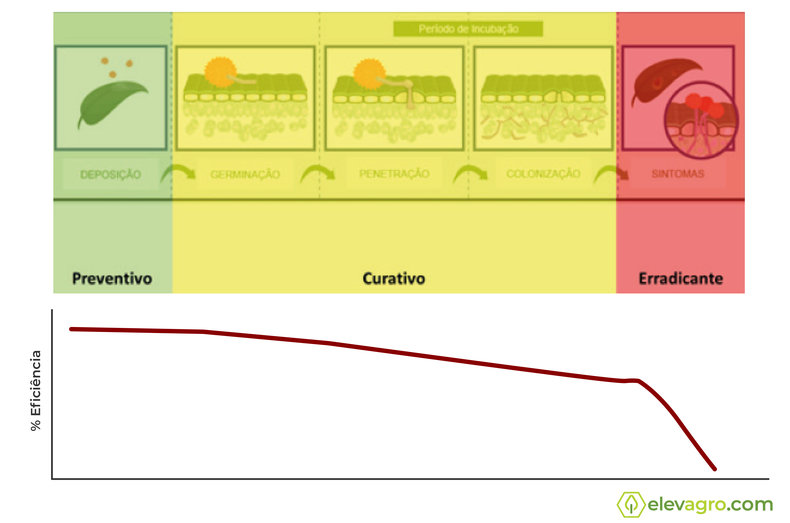
Todos os representantes do grupo das carboxamidas atuam sobre o mesmo sítio de ação mencionado acima.Assim, o posicionamento tardio de qualquer ingrediente ativo do grupo poderá exercer uma pressão de seleção sobre a população do patógeno, acelerando o processo de queda de sensibilidade a todos os outros ingredientes ativos do mesmo grupo, caracterizando risco médio à alto de resistência cruzada (FRAC, 2014, 2017). Portanto, o uso tardio de um produto pode vir a comprometer todo funcionamento deste novo grupo para manejo na cultura da soja (Tabela 1).
| Espécie do patógeno | Reportado | Mecanismo de resistência | Referência |
| Ustilago maydis | Lab | B-H257L | Keon, J.P.R., White, G.A., and Hargreaves, J.A. (1991) |
| Aspergillus oryzae | Lab | BH249Y/L/N,C-T90,D-D124E | Shima, Y., Kaneko, S., Hatabayashi, H., Watanabe, Y., Adachi, Y. and Yabe, Y. (2009) |
| Zymoseptoria tritici | Lab | B-N225I, B-H267Y/R/L, B-I269V, C-A84V, C-H152R, C-T79I, C-N86K, C-G90R, D-H129E and several others | Skinner et al., (1998); Scalliet et al., (2010; 2011); Stammler et al., (2010); Fraaije et al., (2011); |
| Zymoseptoria tritici | Trigo-campo | B-N225T, C-T79N, C-W80S, C-N86S | FRAC Website |
| Phyrenophora teres | Cevada-Campo | B-H277Y, C-N75S, C-G79R, C-H134R, C-S135R, D-D124N/E, D-H134R, D-D145G | Stammler et al., (2014) |
| Botrytis cinerea | Vários-Campo | B-P225L/T/F, B-H272Y/R/L/V, B-N230I, D-H132R, C-A85V | Stammler et al., (2007); Yin et al., (2011); Veloukas et al., (2011); Angelini et al., (2010) |
| Botrytis elliptica | Lírio | B-H272Y/R | FRAC Website |
| Alternaria alternata | Pistache | B-H277Y/R, C-H134R, D-D123E, D-H133R | Avenot et al., (2008;2009); Stammler (2008) |
| Alternaria solani | Batata | B-H277Y/R, D-H133R | FRAC Website |
| Corynespora cassiicola | Cucurbitáceas | B-H278Y/R, C-S73P, D-S89P, D-G109V | 17-18 Miyamoyo et al., (2008, 2010) |
| Didymella bryoniae | Cucurbitáceas | B-H277R/Y | Avenot et al., (2011); FRAC Website |
| Podosphaera xanthii | Cucurbitáceas | B-H->Y (homologous to H272 in B. Cinerea) | FRAC Website |
| Sclerotinia sclerotiorum | Canola | B-H273Y, C-H146R, D-H132R | Glattli et al., (2009); Stammler et al., (2010); FRAC Website |
| Stemphylium vesicarium | Aspargo | B-P225Ç, H272Y/R | FRAC Website |
| Venturia inaequalis | Maçã | C-H151R | FRAC Website |
A utilização de produtos com ingredientes ativos do grupo das carboxamidas, principalmente quando posicionados preventivamente e em mistura com estrobirulinas e triazois, minimiza o risco de tolerância/resistência dos fungos a estes grupos químicos, aumenta a eficácia e a vida útil desta ferramenta.




3 respostas
Muito esclarecedor.
Informações muito úteis.
Ficamos felizes que gostou, Deuseles! Não perca nossos demais conteúdos!